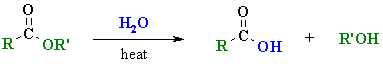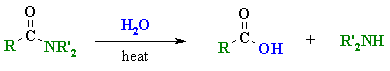บทที่ 10 กรดอินทรีย์
กรดคาร์บอกซิลิกเป็นสารประกอบอินทรีย์ที่มีหมู่คาร์บอกซิล (carboxyl group) เป็นหมู่ฟังก์ชัน ซึ่งหมู่คาร์บอกซิลนี้ประกอบด้วยหมู่คาร์บอนิล และหมู่ไฮดรอกซิล (-COOH)
การเรียกชื่อ
-ชื่อสามัญ
มักเรียกตามแหล่งที่พบ เช่น
HCOOH = กรดฟอร์มิก (formic acid) ได้จากมด
CH3COOH = กรดอะซิติก (acetic acid) ได้จากน้ำส้มสายชู
CH3CH2COOH = กรดโพรพิโอนิก (propionic acid) พบในนม เนย
CH3CH2CH2COOH = กรดบิวทิริก (butyric acid) ในเนยที่เหม็นหืน
CH3CH2CH2CH2COOH = กรดวาเลอริก (valeric acid) พบในรากของวาเลอเรียน
* ถ้ามีหมู่แทนที่เกาะอยู่บนสายโซ่ของกรดคาร์บอกซิลิก ก็ให้ตำแหน่งของหมู่แทนที่ด้วยอักษรกรีก โดยเริ่มนับตั้งแต่คาร์บอนถัดจากหมู่คาร์บอกซิล เป็นตำแหน่ง α β ¥ ตามลำดับ
- ชื่อIUPAC
เรียกชื่อตามจำนวนคาร์บอนอะตอมแบบอัลเคน แต่ตัดตัวลงท้าย e ของอัลเคนออก เติม โออิก เอซิด(-oic acid) เป็นสารประกอบพวก อัลคาโนอิกเอซิดถ้ามีหมู่แทนที่เกาะอยู่บนสายโซ่ของกรดจะให้ตำแหน่งเป็นตัวเลข โดยเริ่มนับจากหมู่คาร์บอนิลของหมู่คาร์บอกซิลเป็นตำแหน่งที่ 1 เสมอ
2. คุณสมบัติทางกายภาพ
- การละลาย
กรดอินทรีย์ เป็นสารอินทรีย์ที่มีขั้ว และสร้างพันธะไฮโดรเจนกับน้ำได้ จึงสามารถละลายน้ำได้ โดยกรดอินทรีย์ที่สามารถละลายน้ำได้ดี จะเป็นสารประเภทโซ่เปิดที่มีคาร์บอน 1 ถึง 4 อะตอม ซึ่งจะละลายน้ำได้ดีทุกสัดส่วน แต่ถ้าน้ำหนักโมเลกุลเพิ่มขึ้นการละลายจะลดลง นอกจากนี้สารประกอบประเภทอะโรมาติกที่เป็นกรดอินทรีย์ จะละลายน้ำได้น้อยมาก
- จุดเดือด
กรดคาร์บอกซิลิกเป็นสารประกอบที่มีขั้วสูงมาก เนื่องจากหมู่คาร์บอกซิล และมีการก่อพันธะไฮโดรเจนซึ่งกันและกันระหว่างโมเลกุลเป็นคู่ ที่เรียกว่า carboxylic acid dimer ทำให้กรดคาร์บอกซิลิกมีจุดเดือดค่อนข้างสูง เมื่อเปรียบเทียบกับสารอินทรีย์ชนิดอื่นที่มีน้ำหนักโมเลกุลใกล้เคียงกัน
- สภาพกรดของกรดอินทรีย์
ผลของเรโซแนนซ์ กรดคาร์บอกซิลิกมีสภาพกรดสูงกว่าอัลกอฮอล์ เนื่องจากกรดคาร์บอกซิลิก สลายตัวให้ H+ และคาร์บอกซิเลตแอนไอออน (RCOO-) ที่เสถียรเนื่องจากเกิดเรโซแนนซ์ ระหว่างออกซิเจนอะตอม
ผลของการเหนี่ยวนำ จะมีผลเมื่อกลุ่มอะตอมที่เหนี่ยวนำดึง อิเลคตรอนอยู่ใกล้หมู่คาร์บอกซิล ทำให้กรดคาร์บอกซิลิกมีสภาพกรดสูง ขึ้น เช่น กรดไตรคลอโรอะซิติก (CCl3COOH) มีสภาพกรดสูงกว่ากรดอะซิติก เนื่องจาก inductive effect ของคลอรีนอะตอม
3. การเตรียมกรดอินทรีย์
3.1 การไฮโดรไลซิสอนุพันธ์ของกรดคาร์บอกซิลิก
ปฏิกิริยานี้เป็นปฏิกิริยาที่น้ำหรือไฮดรอกไซด์ไอออนเข้าไปทำปฏิกิริยากับหมู่คาร์บอนิลของอนุพันธ์ของกรดคาร์บอกซิลิก (หรือหมู่ไซยาไนด์ของสารประกอบไนตริล, RCN) แล้วให้กรดคาร์บอกซิลิกเป็นผลิตภัณฑ์
3.2 ปฏิกิริยา oxidation
3.2.1 ปฏิกิริยา oxidation ของ primary alcohol
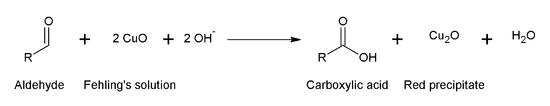
3.2.2 ปฏิกิริยา oxidation ของ aldehyde
3.2.3 ปฏิกิริยา oxidation ของ alkene
4. ปฏิกิริยาของกรดอินทรีย์
4.1 ปฏิกิริยาแสดงความเป็นกรด
4.1.1 ปฏิกิริยากับโลหะได้เกลือกับก๊าซไฮโดรเจน
4.1.2 ปฏิกิริยากับโซเดียมไฮดรอกไซด์ได้เกลือกับน้ำ
4.2 ปฏิกิริยารีดักชัน
กรดคาร์บอกซิลิกสามารถถูกรีดิวส์ด้วย LiAlH4 (lithiumaluminum hydride) ได้แอลกอฮอล์
4.3 ปฏิกิริยาการแทนที่ในวงเบนซีนของกรดเบนโซอิก
จากโครงสร้างของกรดเบนโซอิก จะมีหมู่คาร์บอกซิล ซึ่งเป็นหมู่ที่ดึงอิเล็กตรอนจากเบนซีน เพื่อนำไปเรโซแนนซ์ ทำให้ตำแหน่งที่ง่ายต่อการทำปฏิกิริยาที่สุดจะเป็นตำแหน่ง meta โดยเมื่อกรดเบนโซอิกนำปฏิกิริยาแทนที่ด้วยสารใดๆแล้ว ก็จะเกิดปฏิกิริยาที่ตำแหน่ง meta
4.4 Esterification Reaction
หากว่านำกรดอินทรีย์กับแอลกอฮอล์ไปต้มพร้อมกัน โดยใช้กรดเร่งปฏิกิริยา ผลิตภัณฑ์ที่ได้จะเป็นสารประกอบจำพวกเอสเทอร์ ซึ่งจะมีกลิ่นเฉพาะตัว