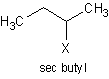แบ่งเป็น 4 แบบ คือ คาร์บอนแรดิคัล คาร์โบแคทไอออน คาร์โบแอนไอออน และคาร์บีน
คาร์บอนแรดิคัล - ขาดแคลนอิเล็กตรอน สามารถให้อิเล็กตรอนได้ดีกว่าไฮโดรเจน ความเสถียรของคาร์บอนแรดิคัล แปรผันตรงกับจำนวนหมู่อัลคิล
คาร์โบแคทไอออน - เป็นสารมัธยันตร์ที่ขาดแคลนอิเล็กตรอน ยิ่งมีหมู่อัลคิลมากขึ้น ความเสถียรของคาร์โบแคทไอออนก็มากขึ้น เช่นเดียวกับคาร์บอนแรดิคัล
คาร์โบแอนไอออน - เป็นสารมัธยันตร์ที่มีอิเล็กตรอน ถ้ามีหมู่อัลคิลเพิ่มขึ้น จะทำให้คาร์โบแอนไอออนมีความเสถียรน้อยลง
6.4 ผลที่เกิดจากการเหนี่ยวนำ
การเหนี่ยวนำ มีผลต่อปัจจัยต่างๆของสารอินทรีย์ เช่น ความเป็นขั้ว ความว่องไวของปฏิกิริยา ความเสถียรของสารมัธยันตร์ ความเป็นกรด-เบสของสาร เป็นต้น
6.5 การเกิดปรากฏการณ์เรโซแนนซ์
การที่อิเล็กตรอนไพ หรืออิเล็กตรอนคู่โดดเดี่ยวผ่านพันธะไพ เรียกการเคลื่อนที่ของอิ
เล็กตรอนว่า ดีโลคัลไลเซชัน ผลของการเกิดเรโซแนนซ์ จะทำให้โมเลกุลมีพลังงานต่ำ และเสถียรขึ้น
บทที่ 2 สารประกอบอัลเคน
อัลเคน เป็นสารประกอบไฮโดรคาร์บอน มีทั้งแบบโซ่ตรง (CnH2n+2) และโซ่ปิด (CnH2n) เป็นพันธะซิกมาทั้งหมด
การเรียกชื่อ แบ่งเป็นชื่อสามัญ และชื่อแบบ IUPAC
ก่อนอื่น เราจะต้องรู่จักคำอุปสรรคที่ใช้ในการเรียกชื่อกันก่อนดีกว่า
C-1 = Meth-
C-2 = Eth-
C-3 = Prop-
C-4 = But-
C-5 = Pent-
C-6 = Hex-
C-7 = Hep-
C-8 = Oct-
C-9 = Non-
C-10 = Dec-
ชื่อสามัญ เป็นชื่อที่นักเคมีแต่งขึ้น เพื่อใช้เรียกสารที่มีสูตรโครงสร้างไม่ซับซ้อน โดยจะมีการบอกลักษณะการจัดเรียงของโครงสร้างด้วย เช่น
n- ย่อมาจาก normal ใช้บอกสารที่เป็นโซ่ตรง เช่น
อ่านว่า n-heptane
iso- ใช้กับสารที่มี Methyl เกาะที่คาร์บอนตัวรองสุดท้ายจากปลายของโซ่ตรงข้าม เช่น
อ่านว่า iso-heptane
sec- ใช้เมื่อมีหมู่อัลคิลเกาะที่คาร์บอนทุติยภูมิ เช่น
tert- ใช้เมื่อมีหมู่อัลคิลมาเกาะที่คาร์บอนตติยภูมิ เช่น
ชื่อแบบ IUPAC มีหลักเกณฑ์ดังนี้
1. เอาคาร์บอนโซ่ที่ยาวที่สุดเป็นหลัก
2. เอาฝั่งที่หมู่อัลคิลมาเกาะเป็นตัวเลขที่มีค่าน้อยกว่าอีกฝั่งหนึ่ง
3. บอกตำแหน่งของอัลคิลที่มาเกาะ พร้อมใช้ - คั่นระหว่างตัวเลขและตัวอักษร
4. ให้เรียกชื่อหมู่อัลคิลที่มาเกาะแต่ละตัว เรียงตามตัวอักษรภาษาอังกฤษ
- mono ,di, tri, tetra มองข้าม
- sec-, tert-, n- มองข้าม
- iso, neo, cyclo นับเรียงอักษร
5. บอกตัวเลขของคาร์บอนที่อัลคิลมาเกาะด้วย
6. ใช้ , คั่นระหว่างตัวเลขกับตัวเลข
7. ถ้ามีโซ่หลักมากกว่า 1 ทาง ให้เลือกโซ่ที่มีอัลคิลมาเกาะมากที่สุดเป็นโซ่หลัก
8. ถ้าหมู่อัลคิลที่โซ่ทั้งสองฝั่งเท่ากัน เลือกฝั่งที่ผลรวมของตัวเลขที่หมู่อัลคิลมาเกาะที่มี ค่าน้อยที่สุด
สมบัติทางกายภาพ
จุดเดือด-จุดหลอมเหลว : ขึ้นตามมวล นอกจากนี้อัลเคนโซ่ตรงจะมีจุดเดือดและจุดหลอมเหลวสูงกว่าโซ่กิ่ง
ความหนาแน่น : อัลเคนมีความหนาแน่นน้อย จึงทำให้อัลเคนส่วนใหญ่ลอยน้ำ (ยกเว้นอัลเคนโมเลกุลใหญ่มาก ๆ)
การละลาย : เป็นสารที่ไม่ละลายน้ำ เพราะไม่มีขั้ว แต่สามารถละลายเข้าด้วยกันเองได้
การเตรียมสารประกอบอัลเคน
- Hydrogenation of alkene and alkyne เตรียมได้โดยการเติมไฮโดรเจนเข้าไปในพันธะไพของอัลคีนหรือแอลคายน์ โดยมีตัวเร่งที่เหมาะสม
- Hydrogenation of alkylhalides โดยให้ alkylhalides ทำปฏิกิริยากับไฮโดรเจน และใช้ตัวเร่งปฏิกิริยา ปฏิกิริยาของสารประกอบอัลเคน
- Halogenation of Alkanes : เป็นการแทนที่ไฮโดรเจนในอัลเคนด้วยธาตุหมู่7 โดยใช้แสงหรือความร้อนเป็นตัวเร่งปฏิกิริยา
- Combusion Reaction : เรียกอีกชื่อว่า การสันดาป ซึ่งจะสันดาปกับออกซิเจนได้ผลิตภัณฑ์เป็นคาร์บอนไดออกไซด์และน้ำ แต่ถ้าออกซิเจนไม่เพียงพอ จะได้ผลิตภัณฑ์เป็น คาร์บอนมอนอกไซด์แทน ถือว่าเป็นการเผาไหม้ไม่สมบูรณ์
สารประกอบไซโคลแอลเคน
เป็นอัลเคนที่มีลักษณะเป็นโซ่ปิด มีคุณสมบัติที่คล้ายคลึงกับอัลเคนโซ่ตรงมาก
การเรียกชื่อ : ใช้หลักการเดียวกับการเรียกชื่ออังเคนโซ่ตรง เพียงแต่จะมีคำว่า cyclo- เติมข้างหน้าสารหลัก
ปฏิกิริยาของสารประกอบไซโคลอัลเคน
เป็นสารที่มีความอิ่มตัวสูง แต่ถ้าเป็นไซโคลอัลเคนที่มีคาร์บอนน้อย ๆ เมื่อเกิดปฏิกิริยาการเติมไฮโดรเจน จะเกิดการแตกวงขึ้น ส่วนวงที่ใหญ่ขึ้น จะไม่เกิดปฏิกิริยา
บทที่ 3 สารประกอบอัลคีน
เป็นสารประกอบคาร์บอนเช่นเดียวกันกับอัลเคน มีทั้งโซ่ตรง(CnH2n) และโซ่ปิด(CnH2n-2) มีทั้งพันธะไพและพันธะซิกมาอยู่ในโมเลกุล
การเรียกชื่อ
การเรียกชื่อสามัญ : เปลี่ยนคำลงท้าย จาก-ane เป็น -ylene
การเรียกชื่อแบบ IUPAC : มีลักษณะการเรียกคล้ายกับอัลเคน เพียงแค่เปลี่ยนคำลงท้ายไปเป็น -ene พร้อมทั้งระบุตำแหน่งพันธะคู่ด้วย
การแทนที่ไฮโดรเจนด้วยหมู่อัลคิลสองหมู่
การแทนที่นี้จะก่อให้เกิดไอโซเมอร์เชิงเรขาคณิตขึ้น ซึ่งจะมีชื่อเรียกต่างกัน คือ cis- และ trans-
การแทนที่ไฮโดรเจนด้วยหมู่อัลคิล สามหรือสี่หมู่
การแทนที่ลักษณะนี้ หมู่อัลคิลที่มาเกาะกับคาร์บอนสายหลักจะไม่ใช่ตัวเดียวกัน แต่ถ้ามาเกาะที่ด้านเดียวกันจะใช้ Z- หากว่าอยู่กันคนละด้านจะใช้ E- นำหน้าสารนั้น ๆ
Z- E-
สมบัติทางกายภาพ
มีแนวโน้มคล้ายกับสารประกอบอัลเคน โดยจะละลายได้ดีในตัวทำละลายอินทรีย์
การเตรียมสารประกอบอัลคีน
- Dehydrohalogenation of alkylhalides by alc. KOH
เป็นการดึงไฮโดรเจนหรือธาตุหมู่เจ็ด ออกมาจากสาร โดยใช้ KOH ที่ละลายในแอลกอฮอล์
- Dehydration of Alcohols
เตรียมโดยการนำกรดแก่มาทำปฏิกิริยากับแอลกอฮอล์
- Reduction of Alkyne
ใช้ไฮโดรเจนเติมเข้าไปในสารประกอบอัลไคน์ แต่ต้องใช้ตัวเร่งให้ถูกต้อง ไม่เช่นนั้นจะได้ผลิตภัณฑ์เป็นสารประกอบอัลเคนแทน
ปฏิกิริยาของสารประกอบอัลคีน
- Addition Reaction of Alkenes
เป็นการเติมไฮโดรเจนหรือฮาโลเจนเข้าไปเพื่อทำลายพันธะไพ แบ่งได้เป็น
1 Halogenation of Alkenes : เติมฮาโลเจนเข้าไปในโมเลกุลเพื่อทำลายพันธะไพ
2 Hydrogenation of Alkenes : เติมไฮโดรเจนเข้าไปในโมเลกุลเพื่อทำลายพันธะไพ