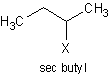- Hydroxylation of Alkenes
เรียกอีกอย่างว่า ปฏิกิริยาฟอกสีด่างทับทิม เป็นการเติม -OH เข้าไปในโมเลกุล โดยใช้สารละลาย KMnO4 ในสารละลายเบสเป็นตัวเร่ง
- Hydration of Alkenes
เมื่อเติมน้ำเข้าไปในโมเลกุลแอลคีน ซึ่งใช้กรดเป็นตัวเร่งปฏิกิริยา จะได้ผลิตภัณฑ์เป็น alcohol
- Ozonolysis of Alkenesใช้ โอโซนเข้าไปทำปฏิกิริยากับแอลคีน จะได้ผลิตภัณฑ์คือสารจำพวกแอลดีไฮด์ และคีโตน
- Polymerization
เป็นปฏิกิริยาของแอลคีนด้วยกันเอง จะเกิดเป็นสารประกอบที่มีโมเลกุลใหญ่ขึ้น โดยหากมีสารตั้งต้นมากเกินพอ ผลิตภัณฑ์ที่ได้จะเป็นพอลิเมอร์
บทที่ 4 สารประกอบอัลไคน์ และอัลคาไดอีน
เป็นสารประกอบที่ไม่อิ่มตัว คาร์บอนจะมีพันธะสามในโมเลกุล (พันธะซิกมา 1 พันธะ พันธะไพ 2 พันธะ) มีสูตรทั่วไปคือ CnH2n-2
การเรียกชื่อ
การเรียกชื่อสารประกอบอัลไคน์นั้นสามารถเรียกชื่อได้สองประเภทเหมือนกับสารประกอบที่ได้กล่าวมาแล้ว ในการเรียกชื่อแบบ IUPAC จะคล้ายคลึงกับการเรียกชื่ออัลคีน โดยต้องระบุตัวเลขตำแหน่งของพันธะสามด้วย เช่น
สมบัติทางกายภาพ
โดยทั่วไปจะคล้ายคลึงกับ สารประกอบอัลเคน และอัลคีน โดยจุดเดือดและจุดหลอมเหลวจะแปรผันตรงกับขนาดของโมเลกุล ไม่ละลายในน้ำ แต่ละลายได้ในตัวทำละลายอินทรีย์
การเตรียมสารประกอบอัลไคน์
การเตรียมอะเซทิลีน
CaC2 + H2O --- > C2H2 + Ca(OH)2 d
การเตรียมอัลไคน์ด้วยปฏิกิริยากำจัดออก
เตรียมได้จาก geminal dihalides หรือ vicinal dihalides โดยมากจะทำในเบสแก่
 |
| vicinal dihalides |
 |
| geminal dihalides |
การเตรียมจากปฏิกิริยาการขจัดออกของสารประกอบเตตระฮาโลเจน
เติมสังกะสีเข้าไปในสารประกอบเตตระฮาโลเจน ผลิตภัณฑ์ที่ได้จะเป็นอัลไคน์
ปฏิกิริยาของอัลไคน์
1 Hydrogenation of Alkynes
เมื่อเติมไฮโดรเจนเข้าไปในโมเลกุลอัลไคน์ ไฮโดรเจนจะเข้าไปทำลายพันธะไพ
2 Synthesis of Alkenes
เป็นการเตรียมสารประกอบอัลคีนโดยการเติมไฮโดรเจนเข้าไป และใช้ตัวเร่งที่เหมาะสม
3 Halogenation of Alkynes
เมื่อเติมฮาโลเจนให้ไปทำปฏิกิริยากับแอลคีน จะได้ผลิตภัณฑ์เป็นเตตระฮาโลเจน ซึ่งไม่ต้องใช้แสงช่วยเหมือนกับแอลเคน
4 Hydration of Alkynes
เป็นการที่ให้น้ำเข้าไปทำปฏิกิริยากับสารประกอบอัลไคน์ โดยจะได้ผลิตภัณฑ์ที่ได้จะขึ้นอยู่กับสารตั้งต้นที่ทำปฏิกิริยา
ถ้าผลิตภัณฑ์เป็น Internal Alkyne ผลิตภัณฑ์ที่ได้จะเป็น ketone
ถ้าผลิตภัณฑ์เป็น Terminal Alkyne ผลิตภัณฑ์ที่ได้จะเป็น methyl ketone
ถ้าผลิตภัณฑ์เป็น Acetylene ผลิตภัณฑ์ที่ได้จะเป็น acetaldehyde
5 Hydrohalogenation of Alkynes
เป็นการเติมสารประกอบจำพวกไฮโดรฮาโลเจนเข้าไปทำปฏิกิริยา โดยจะเป็นการเข้าไปทำลายพันธะไพ
6 Oxidation Reaction
* ถ้าสารตั้งต้นเป็น terminal alkynes ผลิตภัณฑ์ที่ได้จะเป็นกรดอินทรีย์เพียงตัวเดียว และแก๊สคาร์บอนไดออกไซด์
7 Polymerization of Acetylene
เมื่อนำอะเซทิลีนมาทำปฏิกิริยาในหลอดร้อน จะได้ผลิตภัณฑ์ที่เป็นโซ่ปิดเกิดขึ้น